Célula espermática > Defeitos da célula espermática > Saiba mais
Em bovinos, Williams e Savage (1927) e Lagerlof (1938) já relacionavam a presença de defeitos espermáticas em touros ínférteis e estéreis.
Defeitos de cabeça
Em experimentos in vitro,
os espermatozóides com defeitos de cabeça não
são capazes de se ligar ou penetrar o óvulo tão
eficientemente quanto os de cabeça normal.
As diferenças na morfologia da cabeça do espermatozóide
podem causar grandes alterações na hidrodinâmica
da célula e assim interferir no padrão de motilidade
hiperativada (hipermotilidade), que é requerido para a penetração
da zona pelúcida.
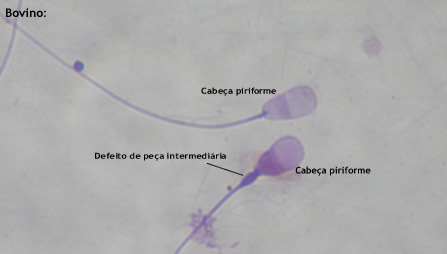
Cabeça piriforme
Considera-se como cabeça piriforme a clássica aparência em forma de pêra: região acrossômica arredondada e um estreitamento na região pós acrossômica. Entretanto, a denominação abrange uma ampla variação de formas defeituosas. No mesmo ejaculado, pode-se encontrar células que apresentam desde uma leve variação de forma até a aparência exata de uma pêra. Muitas vezes, é difícil delimitar com exatidão o que pode ser considerado como uma forma de cabeça normal e o que deve ser considerado como piriforme.
Espermatozóide com alterações de cabeça sofrem uma seleção no trato genital feminino, e são excluídos em locais como cérvix, útero, junção útero tubárica e zona pelúcida, que funcionam como barreiras.
An investigation of the fertilizing characteristics of pyriform-shaped bovine spermatozoa. Thundathil, J.; Palasz,A.T.; Mapletoft, R. J.;. Barth, A. D. Anim. Reprod. Sci., v. 57, n. 1-2, p. 35-50, 1999. Clique aqui para ler o artigo
Gota distal suínos
Como não possuem
ampolas do conduto deferente, os suínos apresentam grande
percentagem de gotas distais nos espermatozóides ejaculados.
Manual de Laboratório para o Exame do Sêmen Humano e Interação Esperma-Muco Cervical
O.M.S., Organização
Mundial de Saúde, 3ª edição
Coloração de sêmen humano
Deve haver uma região acrossômica bem definida compreendendo 40 – 70 % da área da cabeça. Não pode haver defeitos no pescoço, na peça intermediária ou na cauda, e a gota citoplasmática não deve ser de tamanho maior do que um terço do tamanho de uma cabeça normal. Este esquema de classificação requer que todas as formas border-line sejam consideradas anormais. Desde que a análise morfológica aqui recomendada leva em consideração as regiões funcionais da célula espermática, é considerado desnecessário que seja feita a distinção rotineira entre todas as variações no tamanho e forma da cabeça, assim como dos vários defeitos da cauda. No entanto, se uma região do espermatozóide é anormal na maioria das células, uma observação adicional deve ser feita em relação a esse defeito prevalente.
As seguintes categorias de defeitos devem ser anotadas:
-
Defeitos na forma e tamanho da cabeça, incluindo cabeças grandes, pequenas, tapering, piriformes, amorfas, vacuoladas (mais de 20% da área da cabeça ocupada por vacúolos não-corados), ou cabeças duplas, ou qualquer combinação entre todos.
-
Defeitos no pescoço e peça intermediária, incluindo falta da cauda (referidos como cabeças “livres” ou “soltas”), cauda não-inserida ou “pendente” (a cauda forma um ângulo de aproximadamente 90 graus com o eixo maior da cabeça), peça intermediária distendida/irregular/pendente, peça intermediária anormalmente fina (isto é, sem a bainha mitocondrial) ou qualquer combinação destes.
-
Defeitos da cauda, incluindo caudas curtas, múltiplas, dobradas, quebradas (com angulação maior que 90 graus), com largura irregular ou ainda caudas espiraladas ou ainda caudas com gotículas terminais, ou qualquer combinação destes.
-
Gotículas citoplasmáticas maiores que um terço da área de uma cabeça espermática normal.
Coloração de Giemsa para espermatozóides e outros núcleos celulares
Coloração de Papanicolaou – procedimento modificado para espermatozóides
Contagem diferencial da Morfologia Espermática