Experimento de Rutheford
A Experiência Rutherford
Este experimento clássico de difração foi realizado em 1911 por Hans Geiger e Ernest Marsden por sugestão de Ernest Rutherford.

Ernest Rutherford, 1º Barão Rutherford de Nelson , (30 de agosto de 1871 a 19 de outubro de 1937) foi um físico britânico nascido na Nova Zelândia que veio a ser conhecido como o pai da física nuclear.
Rutherford mudou-se em 1907 para a Universidade Victoria de Manchester (hoje Universidade de Manchester ) no Reino Unido, onde ele e Thomas Royds provaram que a radiação alfa é constituída por núcleos de hélio . Rutherford realizou seu trabalho mais famoso depois que ele se tornou um prêmio Nobel. Em 1911, embora não pudesse provar que era positivo ou negativo, ele teorizou que os átomos têm sua carga concentrada em um núcleo muito pequeno , e assim foi pioneiro no modelo de Rutherford do átomo , através de sua descoberta e interpretação de
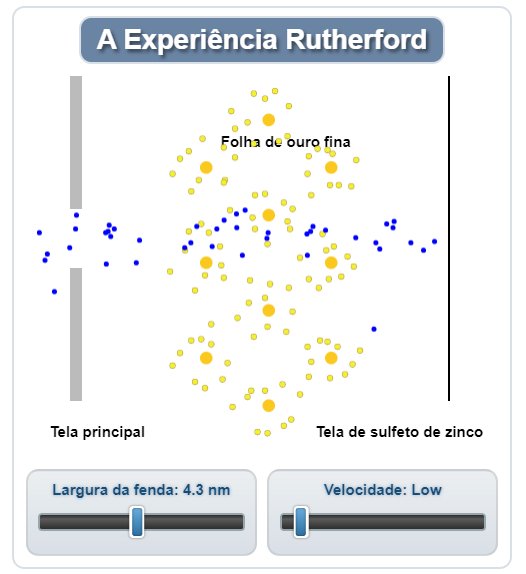
Espalhamento de Rutherford pelo experimento de folha de ouro de Hans Geiger e Ernest Marsden .
Vídeo mostrando a simulação do experimentos de Rutherford
O vídeo mostra a simulação da difração de partículas alfa (núcleos de hélio contendo duas cargas positivas) por uma folha fina feita de metal dourado. Em frente à folha de ouro há uma tela de sulfeto de zinco que emite um flash de luz quando atingida por uma partícula alfa. O controle deslizante na simulação pode ser usado para aumentar a largura da fenda de um intervalo de 0,1 a 9,0 nanômetros. À medida que a fenda é aberta em larguras superiores a 2 nanômetros, algumas das partículas alfa colidirão com os núcleos de ouro, fazendo com que eles se desviem do caminho reto ditado pela fonte de partículas alfa.
Geiger e Marsden esperavam descobrir que a maioria das partículas alfa viajam diretamente através da folha com pouco desvio, com o restante sendo desviado em um ou dois por cento. Esse pensamento baseava-se na teoria de que as cargas positivas e negativas eram espalhadas uniformemente dentro do átomo e que apenas forças elétricas fracas seriam exercidas nas partículas alfa que passavam pela folha fina em alta energia.
O que eles descobriram, para grande surpresa, foi que enquanto a maioria das partículas alfa passava direto pela folha, uma pequena porcentagem delas era desviada em ângulos muito grandes e algumas eram até retroespalhadas.
Como as partículas alfa têm cerca de 8.000 vezes a massa de um elétron e impactaram a folha em velocidades muito altas, ficou claro que forças muito fortes eram necessárias para desviar e retrodifundir essas partículas.
Rutherford explicou esse fenômeno com um modelo revitalizado do átomo no qual a maior parte da massa estava concentrada em um núcleo compacto (segurando toda a carga positiva), com os elétrons ocupando a maior parte do espaço do átomo e orbitando o núcleo à distância. Com o átomo sendo composto em grande parte por espaço vazio, foi então muito fácil construir um cenário em que a maioria das partículas alfa passasse pela folha,