- Modelo atômico de Dalton
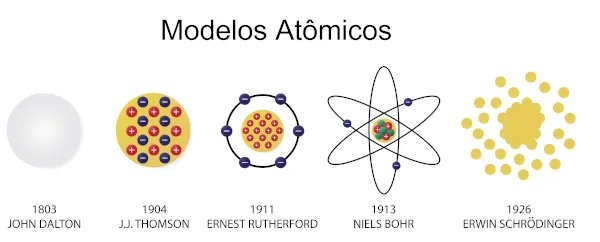
Entre 1803 e 1807, Dalton propôs o primeiro modelo atômico, a primeira hipótese de como seria a estrutura de um átomo. Para ele, o átomo era a menor parte da matéria e não poderia mais ser dividido. Assim, seria uma partícula esférica, maciça, indivisível e indestrutível. O modelo atômico de Dalton ficou conhecido como “bola de bilhar”. Para saber mais, leia: Modelo atômico de Dalton. - Modelo atômico de Thomson
No séc. VI a.C., o filósofo Tales de Mileto já havia constatado experimentalmente a existência de elétrons. Mas só em 1897 Thomson concluiu, por meio de um experimento com tubos de raios catódicos, a existência de partículas menores que o átomo e carregadas com carga elétrica negativa. Foi nesse momento que foi descoberta a primeira partícula subatômica: o elétron.
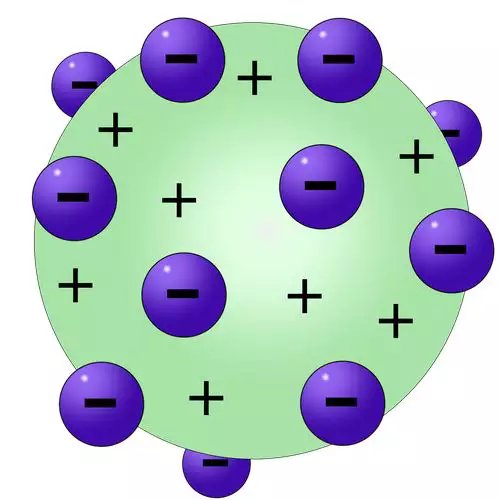
A partir dessa descoberta, foi necessária a criação de um novo modelo, e foi Joseph John Thomson que propôs o modelo atômico formado por uma esfera de cargas positivas com elétrons espalhados em sua superfície. Esse modelo ficou conhecido como “modelo do pudim de passas”.
- Modelo atômico de Rutherford
Em 1911 Rutherford lançou uma nova teoria atômica, contestando a estrutura proposta por Thomson. Hans Geiger e Ernest Marsden foram precursores do modelo atômico proposto por Rutherford.
Supervisionado por Rutherfod, Marsden realizou, em 1909, o experimento da folha de ouro, no qual foi feita uma emissão radioativa de partículas alfa em uma folha de ouro. Com isso, foi observado que muitas partículas atravessavam a folha, mas algumas eram refletidas ou desviadas. A conclusão foi que o núcleo do átomo possuía carga positiva e estava rodeado por elétrons de carga negativa.
Rutherford concluiu também que praticamente toda a massa do átomo estaria concentrada no núcleo, que, mesmo assim, em questões dimensionais, seria muito pequeno em relação ao átomo como um todo.
-
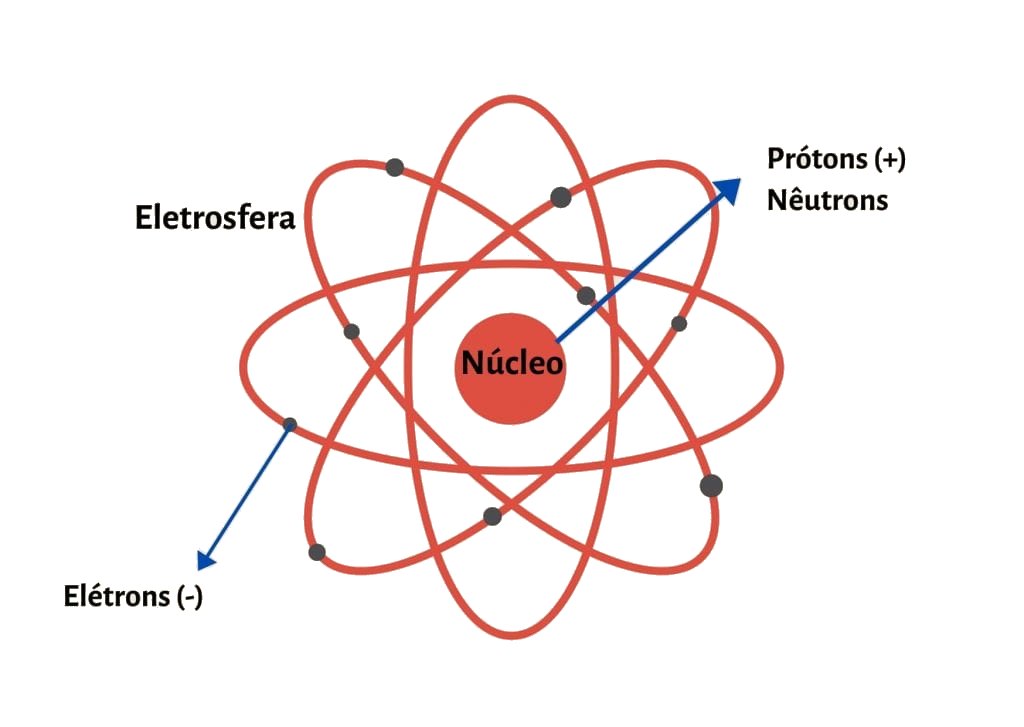
Modelo atômico de Rutherford-Bohr
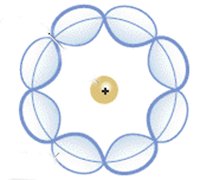
O modelo atômico de Rutherford-Bohr propõe níveis de energia para explicar a distribuição eletrônica do átomo. De acordo com Bohr, a eletrosfera de um elemento é formada por camadas, e as camadas mais distantes do núcleo são as mais energizadas. Os elétrons giram em órbitas fixas, e só existe mudança de orbital ou retirada de elétrons se o átomo for submetido a uma energia externa.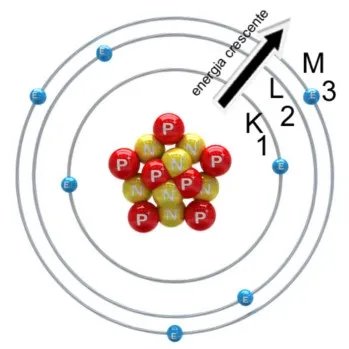
-
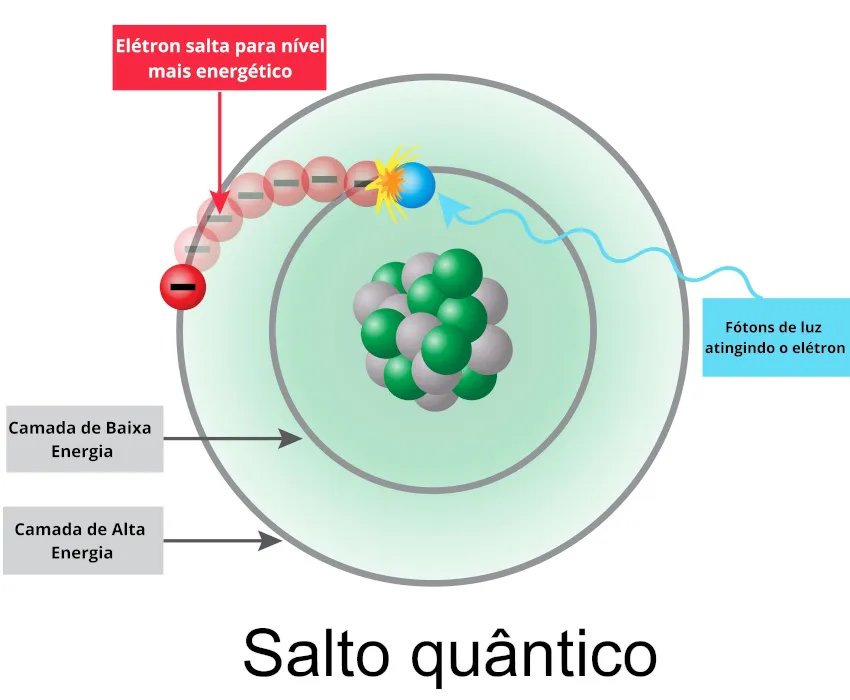
Ainda segundo Bohr, quando um elétron recebe quantum (energia, que pode ser em forma de luz, calor, eletricidade), ele tende a ir para uma camada mais externa, liberar a energia em fótons (luz) e retornar à camada de origem. Esse processo é chamado de salto quântico ou salto energético. Bohr descobriu também a existência de uma partícula sem carga que compunha o núcleo do átomo juntamente aos prótons: os nêutrons.
- Modelo atômico de Schrödinger
A partir do modelo atômico de Rutherford-Bohr, começaram a surgir questionamentos a respeito das partículas subatômicas, principalmente sobre o comportamento dos elétrons e a delimitação da eletrosfera. Foi então enunciado por Werner Heisenberg o Princípio da Incerteza. De acordo com esse princípio, era impossível determinar posição e velocidade de uma partícula. À luz dessa afirmação, não tendo como estipular dados exatos sobre a localização dos elétrons, Schrodinger, por meio de infinitos cálculos matemáticos, determinou uma região de maior probabilidade de se encontrar um elétron. Foi então definido que a eletrosfera teria um formato de nuvem, uma “nuvem de elétrons”.