Elementos radioativos
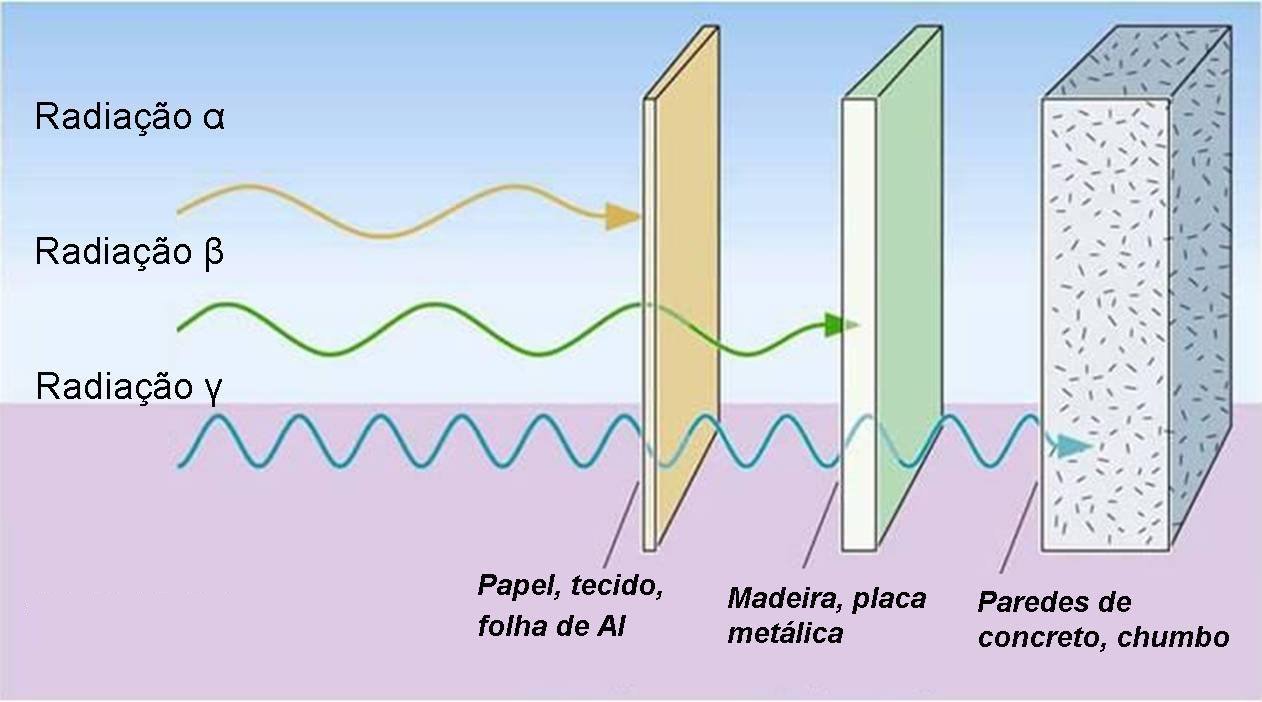
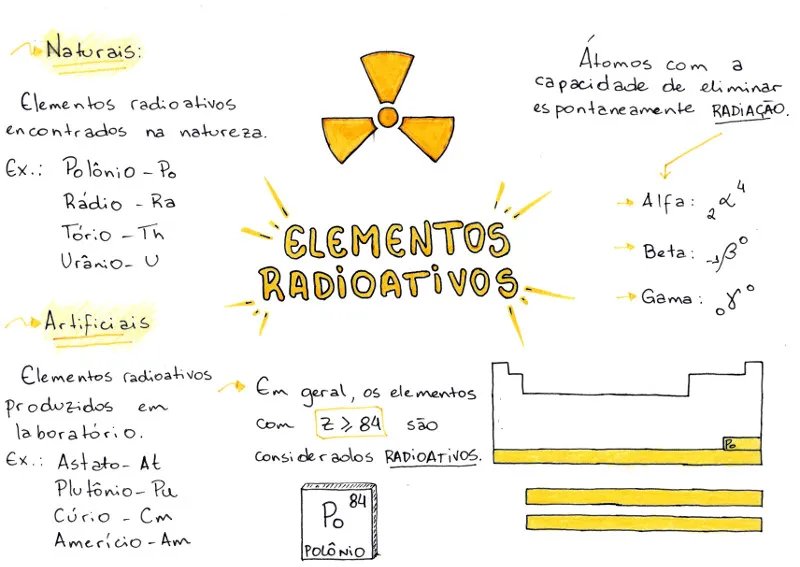
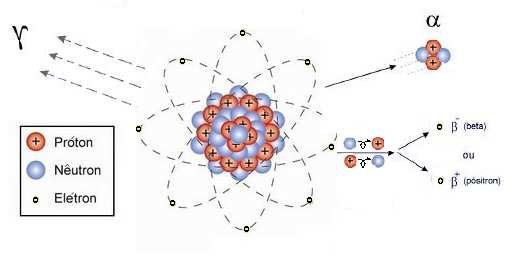
Elementos radioativos são elementos químicos que possuem isótopos instáveis, ou seja, variantes do átomo com um número diferente de nêutrons em seu núcleo. Esses isótopos instáveis passam por um processo de decaimento radioativo, no qual emitem partículas e/ou radiação em busca de uma configuração mais estável.
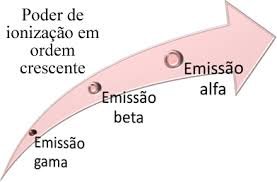
A radioatividade é uma propriedade natural dos elementos radioativos devido à sua composição nuclear instável. Durante o processo de decaimento radioativo, os isótopos instáveis se transformam em isótopos mais estáveis, liberando energia na forma de partículas (como partículas alfa e beta) ou radiação eletromagnética (como radiação gama). Esse processo ocorre até que o núcleo atinja uma configuração mais estável, geralmente em forma de um isótopo estável de outro elemento.

Existem muitos elementos químicos que possuem isótopos radioativos, incluindo urânio, césio, cobalto, iodo, plutônio, rádio, entre outros. Alguns desses elementos radioativos ocorrem naturalmente na Terra, enquanto outros são criados artificialmente em laboratórios ou em reações nucleares.
A radioatividade dos elementos radioativos tem várias aplicações em diferentes áreas, como na medicina (diagnóstico e terapia), na geração de energia em reatores nucleares, na datação de materiais arqueológicos e geológicos, na indústria, na pesquisa científica e muito mais. É importante observar que o uso e manuseio de elementos radioativos exigem precauções e medidas de segurança adequadas devido aos riscos associados à exposição à radiação.